乙酸乙酯的水解反应
乙酸乙酯的水解反应是指在一定条件下,乙酸乙酯分解成乙酸和乙醇的过程。这个反应可以在酸性和碱性条件下进行,但两者的反应机制和产物有所不同。
在酸性条件下,乙酸乙酯水解的反应方程式为:
CH₃COOC₂H₅+
H₂O
=
(可逆)
CH₃COOH
+
C₂H₅OH
这个反应是一个可逆反应,也就是说,反应物可以转化为产物,同时产物也可以转化为反应物。在酸性条件下,通常会使用强酸溶液作为催化剂,加热可以加速反应速率。由于反应是可逆的,因此理论上可以通过调整反应条件来控制反应的进行程度。
在碱性条件下,乙酸乙酯水解的反应方程式为:
CH₃COOC₂H₅+
NaOH
=
CH₃COONa
+
C₂H₅OH
与酸性条件下的水解反应相比,碱性条件下的水解反应是不可逆的。这意味着一旦生成了产物,就不能再转化为反应物。在这种情况下,氢氧根离子会与酯羰基发生加成反应,形成带负电的四面体中间体,中间体不稳定,会消除一个乙氧基负离子,生成乙酸。乙酸与乙醇会发生可逆反应,生成乙酸乙酯。但是,由于生成的乙酸被中和,形成乙酸根离子,这一步在碱性条件下是不可逆的。
乙酸乙酯的水解反应在生活中有广泛应用。例如,在化学实验中,通过控制反应条件,可以实现乙酸乙酯的合成与水解之间的物质循环利用,从而提高***利用率和减少环境污染。此外,乙酸乙酯在食品工业中也有重要应用,例如在酒精饮料中,少量的乙酸与乙醇反应生成具有果香味的乙酸乙酯,使得酒更加美味。
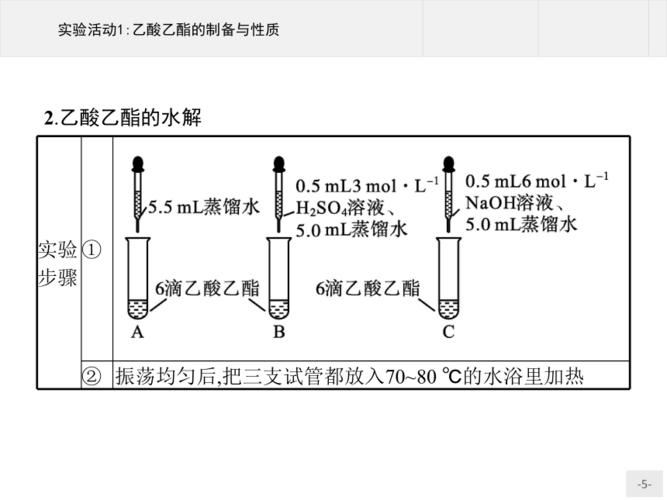
在进行乙酸乙酯的水解反应时,需要注意以下几点:
反应温度:制备乙酸乙酯时,反应温度不宜过高,应保持在60℃~70℃之间,否则可能会产生杂质如乙醚和亚硫酸或乙烯等。
催化剂的选择:可以选择硫酸或氢氧化钠溶液作为催化剂,不同浓度的催化剂对反应结果可能有不同的影响。
防止倒吸:在实验过程中,应避免液体暴沸和倒吸现象的发生。可以预先在试管中加入几片碎瓷片,以防止液体暴沸。
通过上述分析,我们可以了解到乙酸乙酯的水解反应在不同条件下的表现以及其在实际应用中的注意事项。
延伸阅读
参考资料为您提炼了 5 个关键词,查找到 68920 篇相关资料。